烷烃的物理性质 烷烃的物理性质和化学性质是什么
烷烃的物理性质
为大家介绍的是烷烃的物理性质和化学性质是什么和烷烃的物理性质的相关内容,如有不对的地方欢迎指正!
链状烷烃的通式是CnH(2n+2)(n≥1),环烷烃的通式是CnH2n(n≥1)
(1)命名:第一步,确定主链(即最长的碳链)。第二步,从取代基离端口近的一端开始编号,甲乙丙丁戊己庚辛壬癸,十碳以后的就写大写汉字命名就行。第三步,当出现多个不同取代基的时候,根据英文首字母排序,乙基在甲基前面。

命名需要多做做找找感觉,感觉对了基本就没问题了。
(2)物理性质
熔点:①正烷烃,随分子量增加而增加。
②叉链烷烃叉链越多,排列越不紧密,熔点也越低。
③分子在晶格中的排列有关, 分子对称性高的叉链烷烃,排列整齐,熔点反而高。 例如:新戊烷分子对称性高,熔点比正戊烷高。
④碳原子数相同的环烷烃比链烷烃熔点高,因为环烷烃排列的比链烷烃紧密。
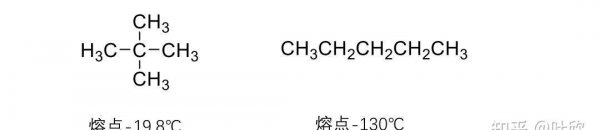
熔点跟分子量,支链数以及晶格能有关。分子量增大,排列紧密的,熔点增大。环状高于链状。
沸点:①随分子量增大而升高②支链越多,沸点越低③环状>链状
注:有机物的物理性质的差异主要是由于自身结构不同,而导致分子间作用力和自身的极性不同。这个单独讲。
密度:①随分子量增大而增大②环状>链状,因为环状比链状排列更紧密
(3)化学性质
①和卤素单质发生的自由基取代(自由基机理,氟氯溴碘活性依次增大,苯甲型H,烯丙型H>三级H>二级H>一级H。)
②小环 环烷烃的开环:
和氢气反应,条件(钯碳加热或者镍高温),一般为对称开环,形成支链多的烷烃
和卤素反应,条件(常温),只有三元环能开环,四元环不反应。极性大的键断裂。当条件是光照或者加热时,不开环,发生卤代。
和卤化氢反应,三四元环都能开环,极性大的键断裂,符合马氏加成。(机理:先开环形成稳定的碳正,然后卤素进攻碳正)
(4)部分常见人名反应
①格氏试剂的制备,一般用于增碳(这个很重要)
…………………………………………………
(1)分子间作用力:主要分三种:范德华力,偶极-偶极相互作用,氢键
范德华力:分色散力,诱导力,取向力。色散力,诱导力:存在于极性分子与非极性分子之间,取向力:极性分子与非极性分子之间
偶极-偶极相互作用:极性分子间的作用力,比范德华力大
氢键:作用力最强,一般和N,O,F形成,分子间氢键会升高沸点,分子内氢键降低沸点
以上就是烷烃的物理性质和化学性质是什么及其烷烃的物理性质的全面介绍了,希望给网友们带来一些相关知识。